Применение химической термодинамики при производстве ферросплавов
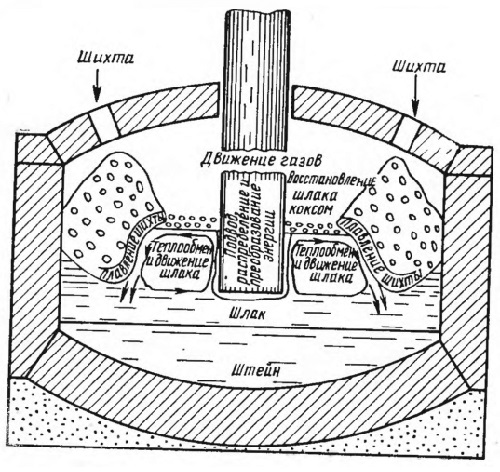
Легирующие элементы имеются в рудах преимущественно в форме оксидов. Если легирующий элемент содержится в форме сульфидов, карбонатов и других аналогичных веществ, то руду в основано подвергают обжигу для трансформации данного элемента в кислородное соединение. В связи с большой прочностью оксидов освобождение легирующих элементов от молекулы кислорода в результате термической диссоциации практически невозможно осуществить. Данные элементы и их сплавы с железом в процессе производства ферросплавов можно получить из руд восстановительным способом.
Возможность восстановления какого-либо оксида оценивается по изменению изобарно-изотермического потенциала. Чем меньше изменяется этот потенциал для формирования этого оксида, тем лучше он восстанавливается.
В теории любой элемент, который способен сформировать крепкий оксид, может применяться в качестве восстановителя для менее крепкого оксида. Прочность оксидов при 1500° С увеличивается в таком порядке: MoO2→FeO→Cr2O3→MnO→СО→SiO2→TiO2→Al2O3→MgO→CaO
В результате, при данной температуре кальций способен восстановить все указанные оксиды.
Массовое распространение на производстве ферросплавов в роли восстановителей получили углерод, кремний и алюминий. Наибольшей экономичностью отличается процесс восстановления углеродом, при отсутствии ограничений по его содержанию в сплаве. На рисунке ниже приведена диаграмма преобразования ∇G0t с температурой для реакции восстановления определенных оксидов углеродом до образования чистого металла и карбидов. Кремний и алюминий применяют в роли восстановителей при производстве без- и малоуглеродистых ферросплавов. В некоторых случаях пользуются комплексным восстановлением сначала углеродом, а потом для обработки шлака пользуются сплавами кремния (к примеру, в процессе выплавки ферровольфрама, силикованадия) или смесь алюминия и ферросилиция или ферросиликоалюминий.
Зависимость реакции восстановления оксидов углеродом от температуры.
Восстановление оксидов при изготовлении ферросплавов производят в присутствии железа или его оксидов, что существенно облегчает восстановительные процессы по следующим причинам:
Восстановление оксидов железа происходит гораздо быстрее оксидов остальных элементов. Восстанавливаемые элементы расщепляются в железе, что понижает их активность и перемещает в результате этого реакцию в сторону восстановления.
Расщепленные в железе элементы уходят из зоны реакции, что, смещает реакцию в сторону восстановления, а также понижает испарение элементов.
У железных сплавов в основном пониженная температура плавления, по сравнению с чистыми легирующими элементами, что дает возможность провести процессы при значительно меньших температурах.
Возможность восстановления какого-либо оксида оценивается по изменению изобарно-изотермического потенциала. Чем меньше изменяется этот потенциал для формирования этого оксида, тем лучше он восстанавливается.
В теории любой элемент, который способен сформировать крепкий оксид, может применяться в качестве восстановителя для менее крепкого оксида. Прочность оксидов при 1500° С увеличивается в таком порядке: MoO2→FeO→Cr2O3→MnO→СО→SiO2→TiO2→Al2O3→MgO→CaO
В результате, при данной температуре кальций способен восстановить все указанные оксиды.
Массовое распространение на производстве ферросплавов в роли восстановителей получили углерод, кремний и алюминий. Наибольшей экономичностью отличается процесс восстановления углеродом, при отсутствии ограничений по его содержанию в сплаве. На рисунке ниже приведена диаграмма преобразования ∇G0t с температурой для реакции восстановления определенных оксидов углеродом до образования чистого металла и карбидов. Кремний и алюминий применяют в роли восстановителей при производстве без- и малоуглеродистых ферросплавов. В некоторых случаях пользуются комплексным восстановлением сначала углеродом, а потом для обработки шлака пользуются сплавами кремния (к примеру, в процессе выплавки ферровольфрама, силикованадия) или смесь алюминия и ферросилиция или ферросиликоалюминий.

Зависимость реакции восстановления оксидов углеродом от температуры.
Восстановление оксидов при изготовлении ферросплавов производят в присутствии железа или его оксидов, что существенно облегчает восстановительные процессы по следующим причинам:
Восстановление оксидов железа происходит гораздо быстрее оксидов остальных элементов. Восстанавливаемые элементы расщепляются в железе, что понижает их активность и перемещает в результате этого реакцию в сторону восстановления.
Расщепленные в железе элементы уходят из зоны реакции, что, смещает реакцию в сторону восстановления, а также понижает испарение элементов.
У железных сплавов в основном пониженная температура плавления, по сравнению с чистыми легирующими элементами, что дает возможность провести процессы при значительно меньших температурах.